《分子科学学报》
天津大学杨建海/刘文广:超软超分子聚合物水凝胶
来源:分子科学学报 【在线投稿】 栏目:综合新闻 时间:2021-03-20【科研摘要】
分子间的氢键密度严重影响氢键合的超分子聚合物水凝胶的凝胶化和流变行为,因此提供了一条微妙的途径来调整其理化性质,以满足特定的生物医学应用。最近,天津大学杨建海/刘文广教授团队引入了N-丙烯酰基甘氨酰胺(NAGA)侧链中两个酰胺之间的一个亚甲基间隔基,以生成变体单体N-丙烯酰基丙氨酰胺(NAAA)。

NAAA在水溶液中的聚合提供了前所未有的超软和高度溶胀的超分子聚合物水凝胶,这是由于额外的亚甲基间隔基导致的H键弱化所致,这一点已通过变温傅里叶变换红外(FTIR)光谱和模拟计算得到了验证。有趣的是,可以调节聚(N-丙烯酰基丙氨酰胺)(PNAAA)水凝胶以形成具有自融合和出色的防污能力的瞬态网络,这是由于弱的双酰胺H键相互作用和增强的水酰胺H键相互作用导致的。这种自融合的PNAAA水凝胶可以完全抑制体内粘连后的术后腹部粘连和复发性粘连。这种短暂的水凝胶网络可使其分解并从体内排泄。分子机理研究揭示了PNAAA水凝胶抑制炎症反应和调节纤溶系统平衡的信号途径。这种自融合,防污的超软超分子水凝胶有望作为一种屏障生物材料来完全防止术后组织粘连。相关论文以题为An Ultrasoft SelfFused Supramolecular Polymer Hydrogel for Completely Preventing Postoperative Tissue Adhesion发表在《Advanced Materials》上。
【图文解析】
基于PNAGA水凝胶对分子结构的微妙敏感性,在这项工作中,作者设计并合成了一种新型的N-丙烯酰基丙氨酰胺(NAAA)单体,该化合物通过使丙氨酰胺与 丙烯酰氯(方案1a)。通过NAAA水溶液的自由基聚合反应制得的聚(N-丙烯酰基丙氨酸酰胺)(PNAAA)水凝胶将出现新的令人兴奋的功能。作者假设弱化的互聚物氢键将导致具有自融合能力的超软PNAAA超分子水凝胶的形成,而增加的水聚合物氢键可提供出色的防止蛋白质吸收和成纤维细胞粘附的能力,这将是有益的 用于术后防粘连(方案1b)。
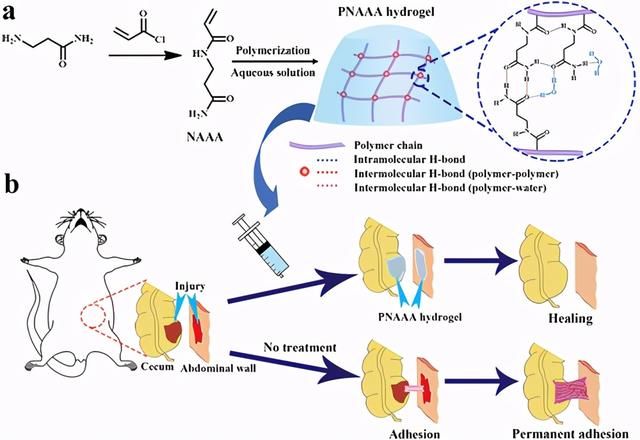
示意图1a,b)具有H键交联网络的超分子PNAAA水凝胶的示意图(a),以及经过或未经过PNAAA水凝胶处理的大鼠盲肠腹壁粘连模型的示意图(b)。
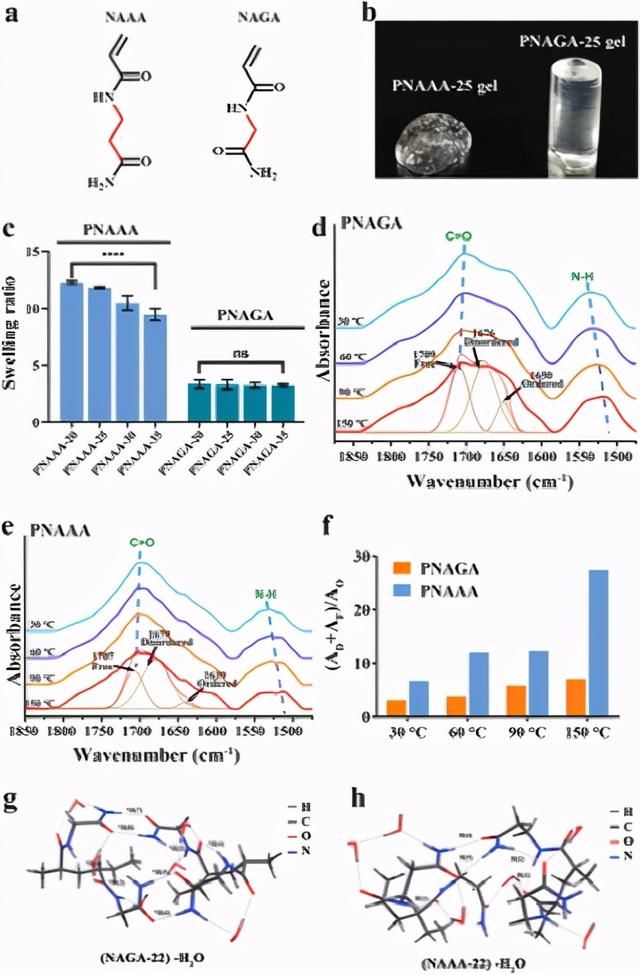
图1a)N-丙烯酰基丙氨酰胺(NAAA)和N-丙烯酰基甘氨酰胺(NAGA)的化学结构。b)在生理盐水中浸泡3天后,PNAAA-25水凝胶和PNAGA-25水凝胶的照片。c)具有不同单体含量的PNAAA水凝胶和PNAGA水凝胶的溶胀率。d,e)PNGA-25水凝胶(d)和PNAAA-25水凝胶(e)的变温FTIR光谱; 虚线是羰基在150°C时的曲线拟合。f)无序氢键羰基和游离羰基的总量与有序氢键羰基的数量之比;AF:游离羰基拟合曲线的积分面积;AD:无序氢键羰基拟合曲线的积分面积;AO:有序氢键羰基拟合曲线的积分面积。g,h)混合有6H2O的双NAGA二聚体(NAGA-22)(g)和双NAAA二聚体(NAAA-22)(h)的构象。
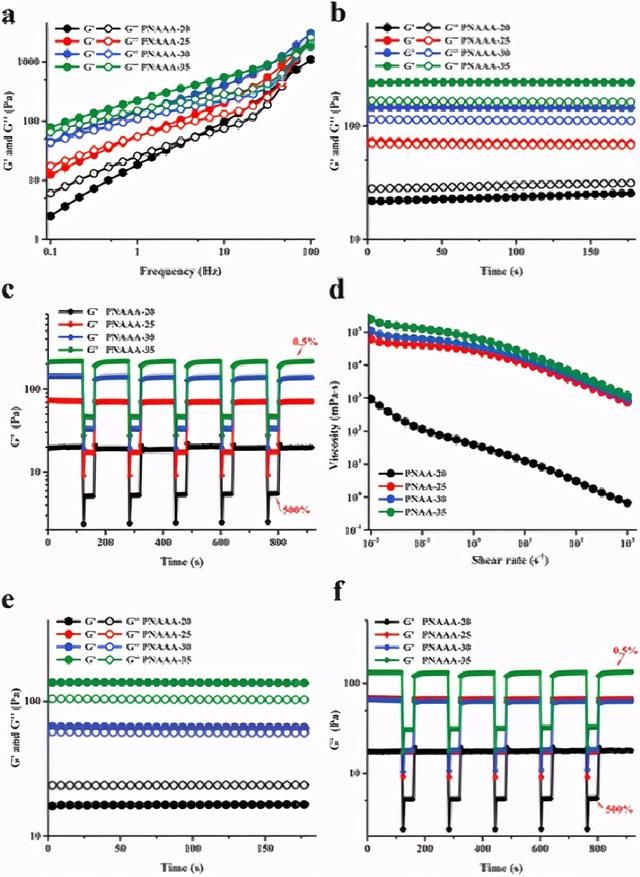
图2PNAAA水凝胶的流变学特性。a)扫频曲线(0.1–100 Hz,应变为1%,37°C)。b)时间扫描曲线(0–3分钟,1 Hz,应变为1%,37°C)。c)阶跃应变曲线,低应变为0.5%,高应变为500%(1 Hz,37°C)。d)剪切速率扫描曲线在0.01–1000 s-1的范围内。e)自融合PNAAA水凝胶的时掠曲线(0-3分钟,1 Hz,应变1%,37°C。f)在低应变0.5%时自融合PNAAA水凝胶的阶跃应变扫描 最高500%(1 Hz,37°C)。
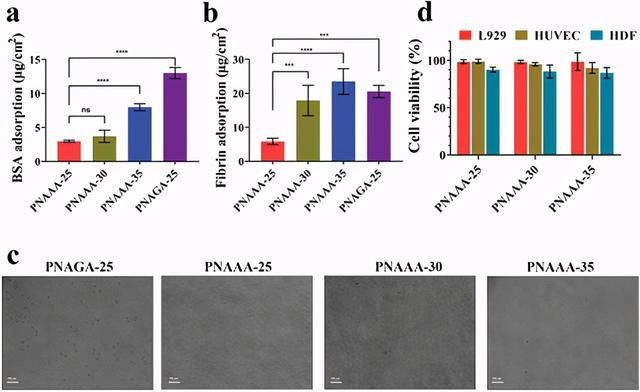
图3自融合PNAAA水凝胶的防污能力和细胞活力。a)BSA在自融合PNAAA水凝胶和PNAGA-25水凝胶上的吸附。b)纤维蛋白在自融合PNAAA水凝胶和PNAGA-25水凝胶上的吸附。c)18小时后,L929细胞在自融合PNAAA水凝胶和PNAGA-25水凝胶上的细胞附着。放大倍率:200×;比例尺:100 m。d)自融合的PNAAA水凝胶的细胞毒性。
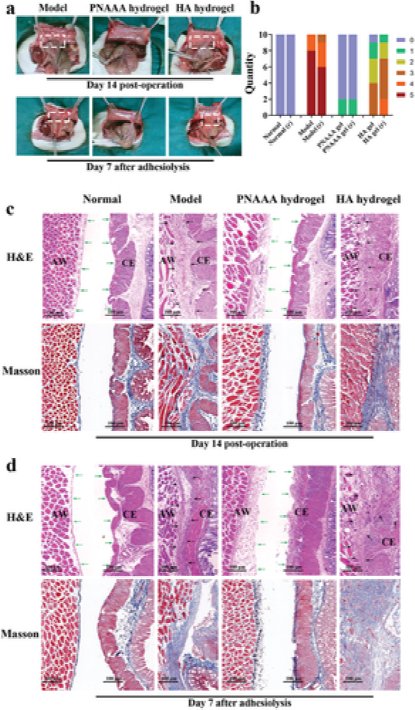
图4自融合PNAAA水凝胶的术后抗粘连能力。a)模型,PNAAA水凝胶和HA水凝胶组在术后第14天和粘连后第7天的腹部粘连的代表性照片。b)在治疗后第14天和粘着溶解后第7天治疗后不同组的粘附力评分。“ r”表示“经常出现”。c,d)术后第14天和粘连后第7天,对正常组,模型组,PNAAA水凝胶和HA水凝胶组的标本进行病理分析。CE:盲肠;AW:腹壁。
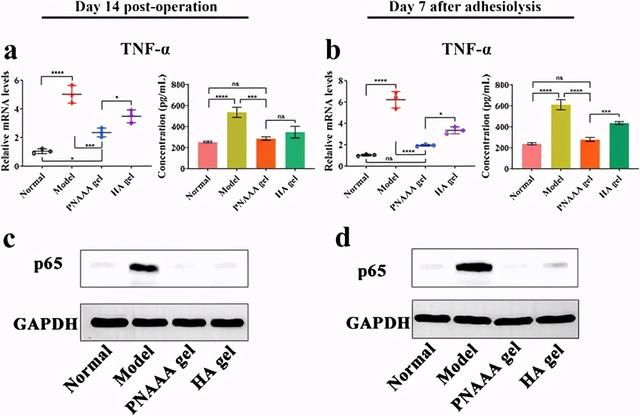
图5自融合PNAAA水凝胶对核因子κB(NF-κB)信号通路的影响。a,b)术后第14天和粘连后第7天,受伤组织中TNF-α的相对mRNA表达和血清中TNF-α的浓度;c,d)在术后第14天和粘着溶解后第7天,p65蛋白在受伤组织中的表达。
