《分子科学学报》
柴胡皂苷-d导致海马神经生成损害的分子机制
来源:分子科学学报 【在线投稿】 栏目:综合新闻 时间:2021-04-01神经干/祖细胞(NPCs)是中枢神经系统(CNS)内具有自我更新能力的多能干细胞。NPCs可以分化为神经元或神经胶质细胞,从而提供足够数量的脑细胞。神经发生是一个十分复杂的过程,其中NPCs要经过增殖,分化为神经元,迁移并整合到具有功能的脑部神经网络中去。有人认为在成年哺乳动物大脑中有两个神经发生区域,其中海马的齿状回(DG)就是其中之一。
成人海马的神经发生十分引人注意,因为这个区域与多种CNS疾病的发生有关。有人认为当海马受到病理性刺激时,海马的神经发生就会受到影响,从而导致神经系统疾病的发生。虽然目前人们对成年人海马神经发生的程度及其与疾病的相关性还有争议,但是越来越多的证据表明在成年啮齿类动物中神经发生持续存在,且与认知功能密切相关。神经营养因子及其受体在海马的表达水平很高,是保持突触可塑性和促进神经系统生存和分化的关键因子。目前已经有研究表明多个神经营养因子与NPCs的神经发生有关。
 南京中国药科大学ShipingMa 教授团队近期在Clinical and Translational Medicine杂志发表了最新研究成果 “Saikosaponin-d impedes hippocampal neurogenesis and causes cognitive deficits by inhibiting the survival of neural stem/progenitor cells via neurotrophin receptor signaling in mice”( 点击文末 “阅读原文” 下载PDF全文 )柴胡皂苷-d(SSd)是一种具有细胞生长抑制作用的三萜系皂甙,在本项研究中作者及其团队旨在阐明SSd在认知功能中的作用以及SSd导致海马神经生成损害和NPCs损害的分子机制。
南京中国药科大学ShipingMa 教授团队近期在Clinical and Translational Medicine杂志发表了最新研究成果 “Saikosaponin-d impedes hippocampal neurogenesis and causes cognitive deficits by inhibiting the survival of neural stem/progenitor cells via neurotrophin receptor signaling in mice”( 点击文末 “阅读原文” 下载PDF全文 )柴胡皂苷-d(SSd)是一种具有细胞生长抑制作用的三萜系皂甙,在本项研究中作者及其团队旨在阐明SSd在认知功能中的作用以及SSd导致海马神经生成损害和NPCs损害的分子机制。
文章概要
作者以往的研究表明SSd具有神经毒性作用,表现为SSd可以抑制海马的神经生成。但是SSd发挥作用的分子机制至今还不十分明确。
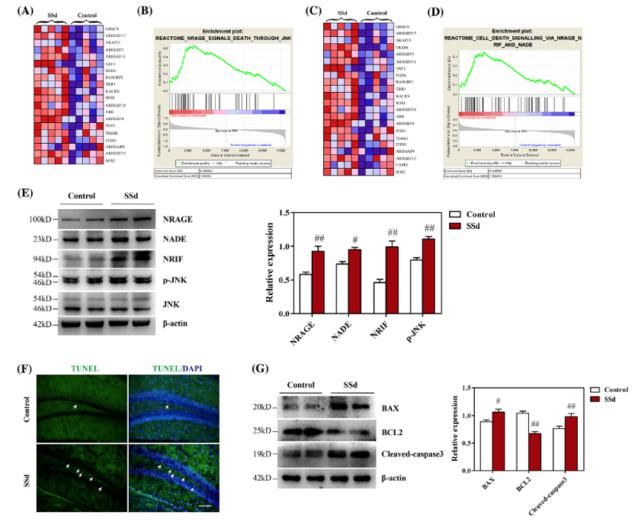
此次发表的最新研究结果表明,在小鼠中,SSd可以引起海马依赖性的认知障碍。SSd可以通过减少新生神经元的数量而抑制海马的神经生成。RNA测序分析表明在海马中SSd导致的神经毒性和p75神经营养因子受体(p75NTR)激活的NRAGE/ NRIF/ NADE信号通路有关。NRAGE代表与神经营养因子受体相互作用的MAGE。NRIF代表神经营养因子受体因子相互作用因子。NADE 代表p75NTR相关的细胞死亡执行因子。
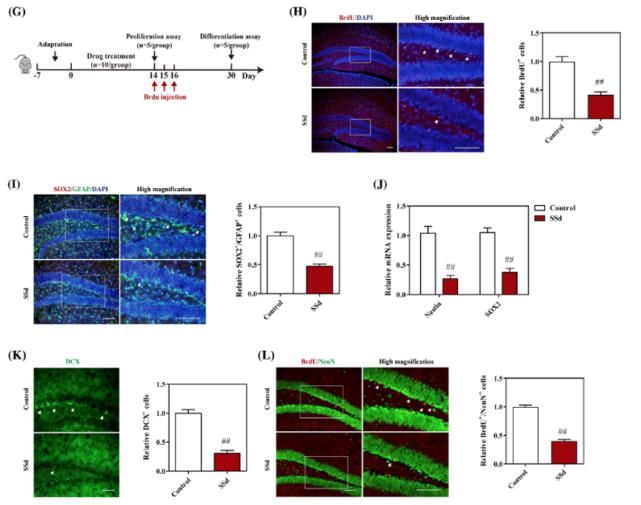 分子机制研究表明一种靶向p75NTR细胞内结构域的短发卡结构RNA可以逆转SSd导致的NRAGE/ NRIF/ NADE信号通路上调以及c-Jun N末端激酶/半胱天冬酶凋亡信号通路的上调,继而导致NPCs的存活,细胞的增殖和分化。重组脑来源的神经营养因子(BDNF)可以缓解 SSd 对BDNF /酪氨酸激酶受体B(TrkB)神经营养信号通路的抑制,但是对SSd激活的pro-BDNF/p75NTR信号通路没有影响。
分子机制研究表明一种靶向p75NTR细胞内结构域的短发卡结构RNA可以逆转SSd导致的NRAGE/ NRIF/ NADE信号通路上调以及c-Jun N末端激酶/半胱天冬酶凋亡信号通路的上调,继而导致NPCs的存活,细胞的增殖和分化。重组脑来源的神经营养因子(BDNF)可以缓解 SSd 对BDNF /酪氨酸激酶受体B(TrkB)神经营养信号通路的抑制,但是对SSd激活的pro-BDNF/p75NTR信号通路没有影响。
此外SSd导致的胞浆内Ca2+浓度上调与NPCs受损有关。细胞外Ca2+螯合的乙烯乙二醇二(2-氨基乙醚)-N,N,N',N'四乙酸(EGTA),而不是细胞内Ca2+螯合的1,2-二(2-氨基苯氧基)乙烷-N,N,N',N'四乙酸四分体(乙酰氧基甲酯)(BAPTA/AM),缓解了SSd介导的胞浆内Ca2+功能异常并下调了SSd TrkB/p75NTR信号通路。
 总之本项研究对SSd神经毒作用的分子机制进行了十分深入的探索。说明 SSd 有十分广阔的药理学研究价值。
总之本项研究对SSd神经毒作用的分子机制进行了十分深入的探索。说明 SSd 有十分广阔的药理学研究价值。
关于期刊
 Clinical and Translational Medicine(CTM)是Wiley出版的英文学术期刊。根据科睿唯安2020年6月公布的期刊引证报告(JCR),CTM获得的首个影响因子为7.919,在JCR的138本Medicine, Research & Experimental 期刊中位列第11,在244本Oncology期刊中位列第27,均处于Q1区。
Clinical and Translational Medicine(CTM)是Wiley出版的英文学术期刊。根据科睿唯安2020年6月公布的期刊引证报告(JCR),CTM获得的首个影响因子为7.919,在JCR的138本Medicine, Research & Experimental 期刊中位列第11,在244本Oncology期刊中位列第27,均处于Q1区。
CTM刊登临床和转化医学方面的文章,旨在促进临床前研究向临床应用的转化,加强基础和临床科学家之间的交流。本期刊聚焦新生物技术、生物材料、生物工程、疾病特异性生物标记物、细胞和分子医学、组学科学、生物信息学、应用免疫学、分子成像、药物发现和开发以及监管和卫生政策。CTM竭诚欢迎临床医生、研究人员、决策者和业界人士免费阅读期刊内容并积极向期刊投稿。
最新一期Clinical and Translational Medicine已上线,欢迎扫码免费在线阅读:
