《分子科学学报》
这种让你肚子疼的分子机制找到了!西湖Cell论文
来源:分子科学学报 【在线投稿】 栏目:综合新闻 时间:2022-04-07本文转载自 公众号 西湖大学WestlakeUniversity
量子位 | 公众号 QbitAI
科学研究有时候就像福尔摩斯破案,面对看不见摸不着的对手,需要大胆假设,小心求证,外加细致入微的观察。
“艰难梭菌”就是陶亮博士的对手之一。这是一种造成医院和社区感染腹泻及肠炎的重要病原体,近年来在全球各地造成了一系列爆发性感染,被美国疾病预防控制中心列为最高级别威胁的耐药病菌。
陶亮对此跟踪研究了9年。从2013年在哈佛医学院做博士后至今,他一直在研究包括艰难梭菌在内的病原细菌与宿主之间的相互作用。简单说,就是解释艰难梭菌如何入侵人体并致病。
现在,他们有了新的重要发现。
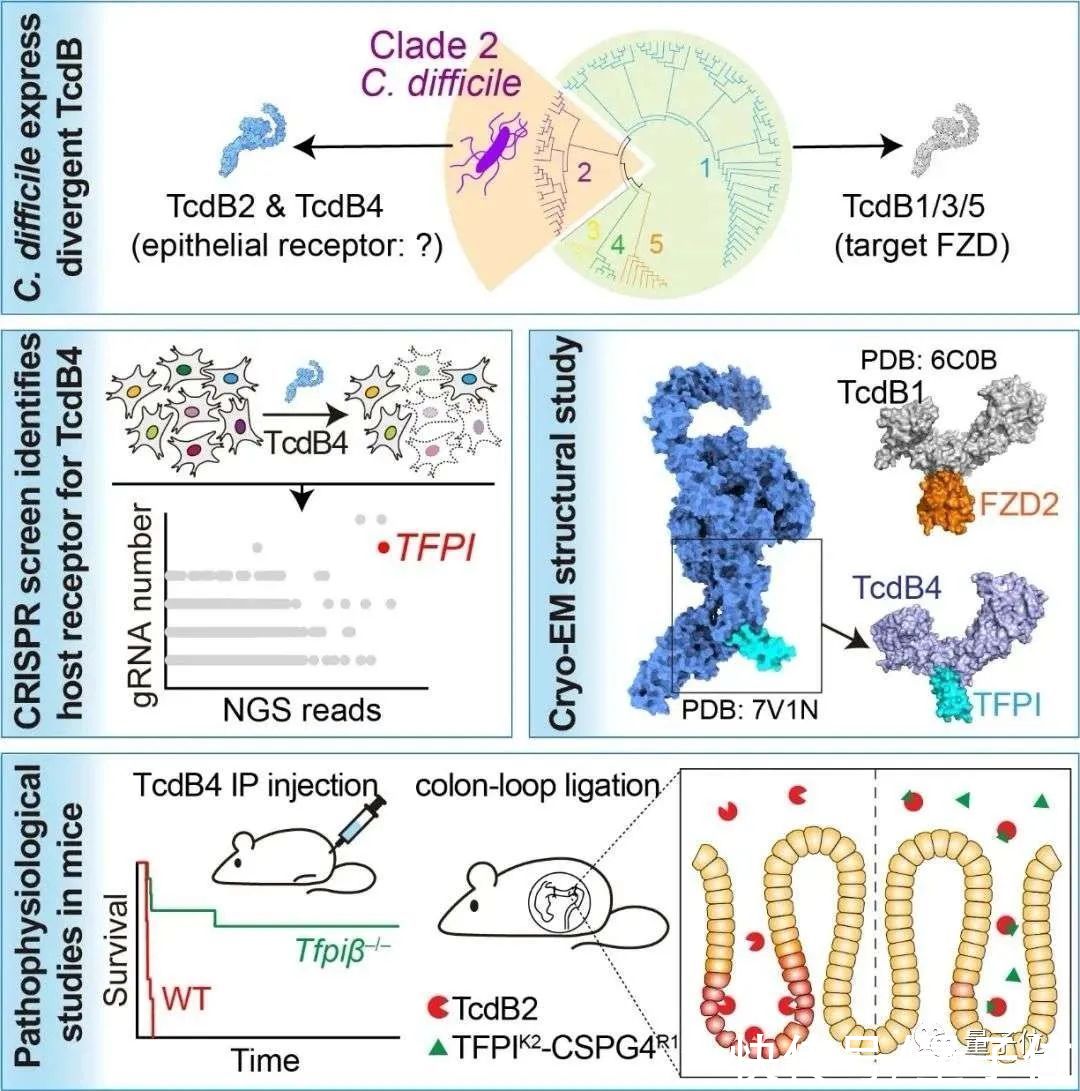
最近,西湖大学生命科学学院陶亮团队与施一公团队合作,在《细胞》(Cell)在线发表题为“TFPI is a colonic crypt receptor for TcdB from hypervirulent clade 2?C. difficile”的最新研究成果,首次揭示了超毒力分支艰难梭菌毒素B的肠道上皮受体——TFPI蛋白。
这意味着,他们发现了艰难梭菌毒素B入侵人体的新“大门”。

△论文截图
为什么盯上艰难梭菌?
艰难梭菌是一种厌氧的革兰氏阳性细菌,因为分离培养比较困难,所以得名“艰难”。它普遍存在于环境中,包括空气、水、土壤、动物和人类的粪便中。而人体肠道内也是一个它适合定居的场所。
艰难梭菌感染之所以如此严重,抗生素的滥用难辞其咎。当长期使用抗生素,破坏人体正常肠道菌群时,艰难梭菌就会乘虚而入,大量繁殖,引发伪膜性肠炎、腹泻、肠穿孔等多种疾病症状,严重时会威胁生命。
过往研究表明,艰难梭菌有5个主要的进化分支,包括Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ型,其中II型分支由于其强致病性,又被称为“超毒力分支”,是近年来在北美、欧洲等地区造成数次爆发性感染的罪魁祸首。
艰难梭菌会产生三种毒素 :毒素 A、毒素 B 和二元毒素。其中,毒素B(TcdB)是艰难梭菌致病的关键“武器”,而不同分支产生的毒素B,则又分属不同的亚型(以TcdB1、TcdB2等方式标注)。
它从“另一扇门”入侵人体
此前,陶亮团队关于经典型的艰难梭菌毒素B在肠道上皮细胞中受体的研究工作,获得了业内广泛的关注和认可。他们已经发现了TcdB1、TcdB3、TcdB5重要的宿主细胞受体——FZD蛋白(注,FZD蛋白也是重要的WNT信号通路的受体)。可以简单理解为,他们已经破解了部分TcdB是如何通过 “大门”进入肠道上皮细胞的。
但作为另一大“毒王”,“超毒力分支的艰难梭菌”专有表达毒素B的两种变体(亚型)——TcdB2和TcdB4,均不识别FZD蛋白。
不知道“大门”在哪里,这两种毒素变体又是如何进入细胞中的?
△论文图文摘要
陶亮团队尝试敲除细胞中的FZD蛋白(经典受体),细胞依然对TcdB4高度敏感。他们猜测,一定存在“另一扇门”——即某种未知受体介导了变体的毒素B入侵细胞。
利用一种名为CRISPR/Cas9的基因敲除文库筛选技术,陶亮团队排查出了一系列相关的候选因子,即“怀疑对象”。经过分析后,他们锁定了一个名为组织因子途径抑制因子(TFPI)的蛋白,认为这个存在于细胞表面的蛋白“涉案”可能性最大,很可能就是这两种毒素B变体进入细胞的“另一扇门”。
TFPI就是隐匿已久的新通道
为了验证这一猜想,研究团队思维缜密地设计并进行了各种不同类型的实验。
关键实验之一,敲除TFPI这扇“大门”,看TcdB4是否还能闯入细胞。
TFPI在哺乳动物中存在α和β两种主要的同源异构体,两种形式都具有介导TcdB4进入细胞的能力。由于TFPI全敲除会导致小鼠死亡,研究团队构建了TFPIβ敲除的小鼠。随后对小鼠进行腹腔注射TcdB4进行毒素挑战实验,发现有超过60%的纯合型(TFPIβ?/?)小鼠存活了下来。“证明TFPI是TcdB4的关键受体,并且显示了肾脏是全身系统感染下的主要受损器官”,陶亮说。
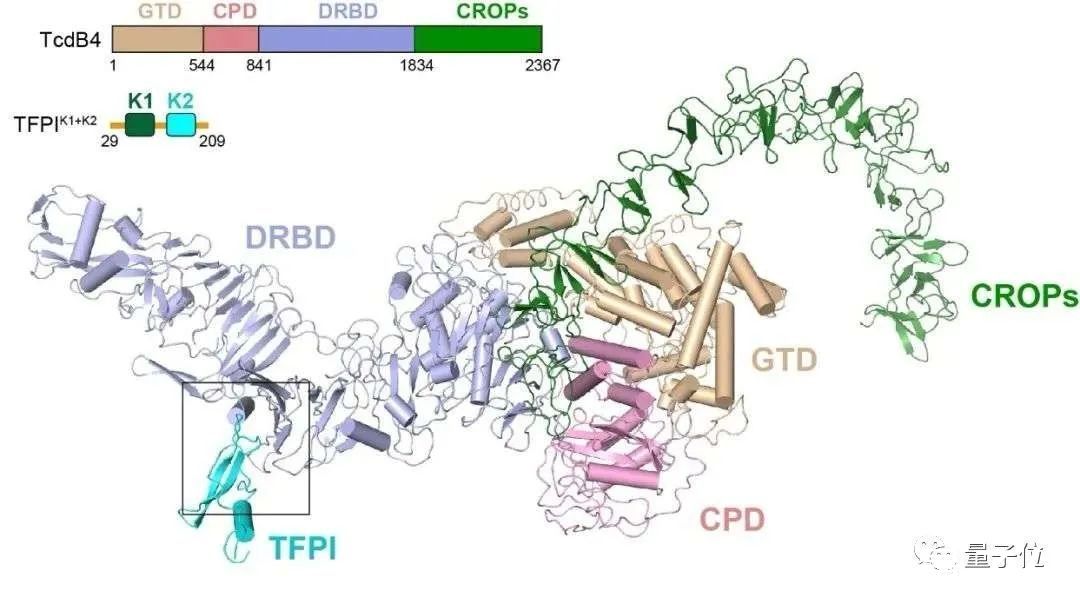
△TcdB4和TFPI形成复合物的三维结构图
关键实验二,从分子水平直接“看到“毒素和受体的结合。
