《分子科学学报》
哈工大一课题组在《科学》(Science)发文揭示人
来源:分子科学学报 【在线投稿】 栏目:综合新闻 时间:2022-08-22分泌型sIgM通常形成五聚体,但在膜结合的静息态BCR上只观察到IgM的单体状态。结构分析显示Igα的Ig样结构域和膜结合的IgM-Cμ4完全重合,从而解释了膜结合的静息态IgM-BCR为什么处于单体状态。BCR的激活通常伴随着BCR多聚体的形成,静息状态下,由于Igα/β的Ig样结构域与Cμ4或Cγ3结合,在空间上阻断了mIg寡聚化,而当抗原结合后可能会对Fab结构域施加机械力,以触发mIg_Fc的结构变化,从而释放被Igα/β占据的Cγ3或Cμ4的寡聚体界面,导致BCR分子形成寡聚体启动下游信号转导,其潜在机制还有待进一步研究。电子密度分析分别在IgG和IgM-BCR上清晰地鉴定出6个和14个糖基化位点。
人类适应性免疫细胞(T细胞和B细胞)在病原感染、癌症发生以及自体免疫疾病中起着关键作用。T、B细胞分别通过T细胞受体(TCR)和B细胞受体(BCR)识别抗原信号,把信号跨膜传递至胞内,激活T、B细胞的免疫反应。T、B细胞受体属于一类由多个蛋白组成的最复杂的细胞受体,对T、B细胞的发育、分化、功能起着至关重要的作用。TCR和BCR复合物信号转导,免疫激活的结构基础与分子机制问题一直是免疫学领域的重要基础科学问题。
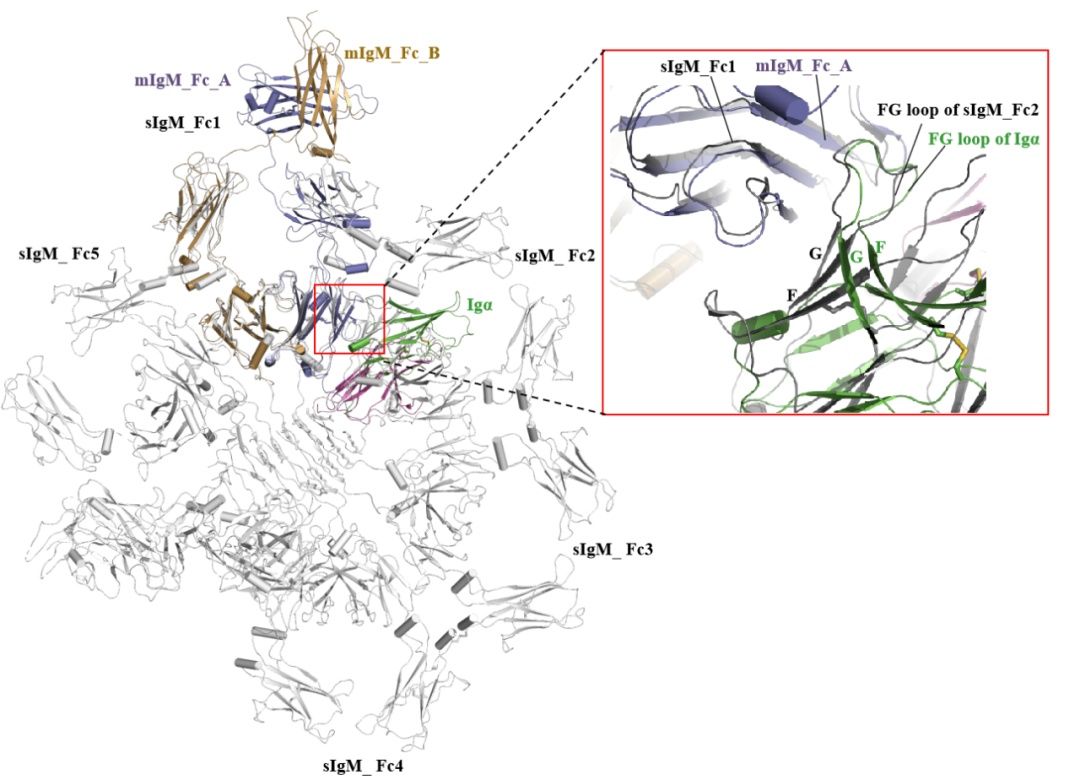
分泌型sIgM和膜结合型mIgM-BCR复合物结构比较
上述数据不仅解析了长久以来关于BCR结构与组装机制之谜,且对认识BCR启动免疫反应的分子机制,以及开发靶向BCR的免疫疗法用于治疗相关疾病提供了关键结构基础。
人类B细胞受体有5种亚型,在该研究中,该课题组解析了人IgG和IgM两种亚型的BCR复合物结构,BCR复合物结构包含了一个膜结合形式的免疫球蛋白(mIg)同源二聚体,用于识别抗原,以及一个膜结合形式的Igα/β(CD79α/CD79β)异二聚体,用于信号传递(化学计量比为1:1)。其中,mIg二聚体包含了Fab和Fc结构域、连接肽(CPs)和跨膜(TM)螺旋,Igα/β结构由两个胞外Ig样结构域、CPs和TM螺旋组成。IgG和IgM-BCR复合物的组装分别由胞外的IgG-Cγ3和IgM-Cμ4与Igα/β的Ig样结构域,以及连接肽、跨膜螺旋承担。课题组通过两个亚型的结构比较发现,mIgG和mIgM的跨膜螺旋区通过保守的疏水和极性作用与Igα/β 结合。相比之下,在胞外区域,IgG-Cγ3和IgM-Cμ4分别通过“首尾相连”(head-to-tail)以及“肩并肩”(side-by-side)的模式与Igα/β的Ig样结构域结合,其中,Igα的CD loop 旋转了90度,分别与Cγ3和Cμ4结构域结合。结构上观察的不同亚型组装模式是否和活性有关值得进一步研究。
同期《科学》(Science)“观点(Perspective)”栏目发表了评论文章《揭开B细胞受体结构面纱——分子结构为理解和控制B细胞受体活性提供了路径》(Unveiling the B cell receptor structure - Molecular structures provide a road map for understanding and controlling B cell receptor activation),对该研究成果进行了介绍。
论文链接:
哈尔滨工业大学生命学院/生命科学中心黄志伟课题组在《科学》(Science)上发表题为《两种亚型的人类B细胞受体的冷冻电镜结构》(Cryo-EM structures of two human B cell receptor isotypes)的研究文章,揭示了BCR复合物亚基的组装、识别机制,以及发现不同亚型BCR尽管在膜内具有保守的组装模式,然而在胞外却具有不同的组装模式。
本文转自:人民日报客户端
近年来,在人免疫细胞受体的结构与分子机制研究方面,黄志伟课题组首先通过解决TCR、BCR复合物的动态复杂性等技术问题,解析人TCR复合物的三维结构,揭示TCR复合物的亚基组装、识别机制(Nature, 2019)。课题组通过进一步解析高分辨率的TCR复合物结构,发现TCR跨膜区域存在“胆固醇结合通道”(Molecular Cell, 2022),胆固醇分子结合于该通道抑制TCR激活,通过去除胆固醇分子引起TCR组成型激活,揭示了TCR激活的结构基础,从而提出TCR的“胆固醇——门栓”控制理论,为理性设计靶向TCR调控T细胞活性的免疫疗法提供理论依据。
哈尔滨工业大学生命学院/生命科学中心黄志伟教授为本论文的通讯作者。生命学院2021级博士研究生马新宇、朱玉威副研究员、董德博士、陈彦博士为该论文的并列第一作者。生命学院2021级博士研究生王书博、张帆研究员、郭长友博士等参与该研究的部分工作。本项目受到国家自然科学基金委、腾讯科学基金、哈工大青年科学家工作室等基金的资助。
张艺开